当暴露于外部抗原时,T细胞被迅速激活,其从静止状态到增殖状态的转变需要经历细胞代谢的巨大变化,尤其是糖酵解、谷氨酰胺分解和线粒体代谢的增加,以产生高水平的能量和生物合成前体,从而满足T细胞的生长和克隆扩增、以及随后的分化。T细胞新陈代谢的增加,依赖于翻译爆发而产生的代谢酶,并产生克隆性T细胞子代及其细胞因子的蛋白质组分【1, 2】。然而,矛盾的是,快速的T细胞扩增也伴随着活性氧(ROS)浓度的增加。ROS作为增强的线粒体代谢的副产物,可作为T细胞受体(TCR)信号的第二信使,在T细胞活化过程中激活重要的转录因子,促进T细胞增殖。然而,T细胞激活过程中产生的ROS还可造成tRNA断裂、翻译抑制和应激颗粒的形成【3, 4】。其中tRNA片段化可以抑制蛋白质的整体翻译,通过类似microRNA的作用抑制特定靶mRNA的翻译,调节mRNA的稳定性。tRNA来源的片段(tRF),尤其是大小接近tRNA一半(30-40 nt)的tiRNA,通常在应激时产生并形成应激颗粒(通过阻断翻译起始因子抑制整体翻译的细胞质RNA蛋白复合物)【5】,但是目前就在T细胞激活过程中引起tRNA断裂的原因尚不可知。同时,研究发现,在抗氧化物质缺乏的情况下,ROS的积累会损害代谢重编程和T细胞的增殖【6】。由此提示,为了保持ROS的信号活性,抗氧化应激的保护机制可能不只是发生在单纯降低T细胞ROS水平上。
基因筛查发现一种叫做elektra的突变,可以通过Schlafen2(Slfn2)基因的单一功能缺失错义突变导致小鼠免疫缺陷【7】。SLFN2是Schlafen基因家族的一员,主要存在于哺乳动物中,该家族于1998年通过筛选胸腺细胞发育的调节因子时首次被确定,由于缺乏与其他蛋白家族的同源性,Schlafen蛋白的功能和作用机制仍不清楚。研究发现,Slfn2突变与T细胞活化受损有关,然而,Slfn2是否直接调控T细胞功能,以及如何调控尚不清楚。
基于以上,近日,来自美国德克萨斯大学西南医学中心的Bruce Beutler团队在Science在线发表题为SLFN2 protection of tRNAs from stress-induced cleavage is essential for T cell–mediated immunity 的文章,提供了TCR和共刺激受体参与导致的T细胞氧化应激反应的证据,其特征表现为诱导tiRNA、翻译抑制和应激颗粒形成;描述了一种SLFN2保护tRNA免受氧化应激诱导的断裂的保护机制,以此阻止了T细胞激活时产生的ROS的翻译抑制作用,从而为SLFN家族成员在RNA和翻译调控中的关键作用提供了进一步的支持,也由此揭示了T细胞介导免疫所必需的机制——T细胞依赖于SLFN2以维持其快速、丰富的蛋白质翻译能力。

本文研究人员首先构建了CD4+和CD8+T细胞条件性敲除Slfn2的小鼠模型,实验发现,T细胞特异性SLFN2缺陷(Slfn2–/– T细胞)小鼠对T细胞依赖性抗原免疫和小鼠巨细胞病毒感染分别表现出体液免疫和细胞免疫应答受损,提示SLFN2在T细胞中的作用是T细胞介导免疫所必需的。与此同时,研究人员还发现Slfn2–/– T细胞小鼠的实验性自身免疫性脑脊髓炎(EAE,多发性硬化小鼠模型)发病程度更轻,提示SLFN2在这种自身免疫环境中对T细胞功能也至关重要。进一步地,研究人员发现,T细胞特异性SLFN2缺陷导致的T细胞功能受损源于T细胞对TCR刺激的增殖反应受损,尽管在Slfn2–/– T细胞中TCR信号事件被正常诱导。
已知通过TCR刺激T细胞可以使高亲和力IL-2受体(IL-2R)的转录和翻译上调,诱导IL-2分泌和对IL-2的反应,从而导致自分泌-旁分泌信号和T细胞增殖。虽然本研究发现Slfn2–/– T细胞所产生的IL-2不受影响,但是其在外源性IL-2刺激下无法增殖。进一步地实验显示在Slfn2–/– T细胞中IL-2R信号通路受损,并且细胞表面的IL-2Rβ和IL-2Rγ的表达显著降低,而这与SLFN2缺陷T细胞中的翻译受损直接相关——对照T细胞在TCR激活后8至24小时内即可启动翻译爆发,但这种翻译在SLFN2缺陷T细胞中显著减弱,从而可能导致细胞增殖失败。
进一步地,研究人员发现SLFN2可以直接与tRNA结合并形成稳定的复合物,然而,与SLFN11和SLFN13不同,由于缺失了两个对核糖核酸酶(RNase)活性重要的酸性残基, SLFN2并不切割tRNA。相反,研究人员在SLFN2缺陷的T细胞中发现了tRNA片段的异常积累和亲本全长tRNA的减少,并且这些现象在T细胞活化后变得更加明显。此外,抗原刺激后,虽然与对照T细胞相比,Slfn2–/– T细胞产生的ROS的数量差不多,但是当给予其抗氧化剂时,Slfn2–/– T细胞中tiRNA的积累显著减少;反之,给予未受刺激T细胞H2O2刺激时,Slfn2–/– T细胞中的tiRNA积累过剩,由此提示SLFN2缺陷的T细胞中的tRNA对于氧化应激更敏感,更容易被裂解。而这又与Slfn2–/– T细胞中翻译减少密切相关。与此同时,研究结果表明,在激活的SLFN2缺陷型T细胞中对ROS的抗氧化抑制足以大大减少tiRNA的异常积累以及随后的翻译抑制和应激颗粒组装,从而增加激活诱导的SLFN2缺陷T细胞的增殖。在激活的T细胞中,氧化应激是核糖核酸酶ANG诱导表达的必要因素,而ANG是氧化应激时切割产生tiRNA的主要酶。体外和体内实验均表明,ANG介导了SLFN2缺陷的T细胞中tRNA的裂解,导致TCR刺激下的翻译和细胞增殖受损。在Slfn2–/– T细胞中敲低ANG或过表达ANG抑制蛋白RNH1均可减少tiRNA的积累,提高细胞内蛋白翻译速率。由此表明SLFN2可以直接抑制ANG对tRNA的裂解,SLFN2与tRNA的直接结合是保护tRNA不被切割的必要条件,从而在T细胞活化过程中保证翻译的正常进行。
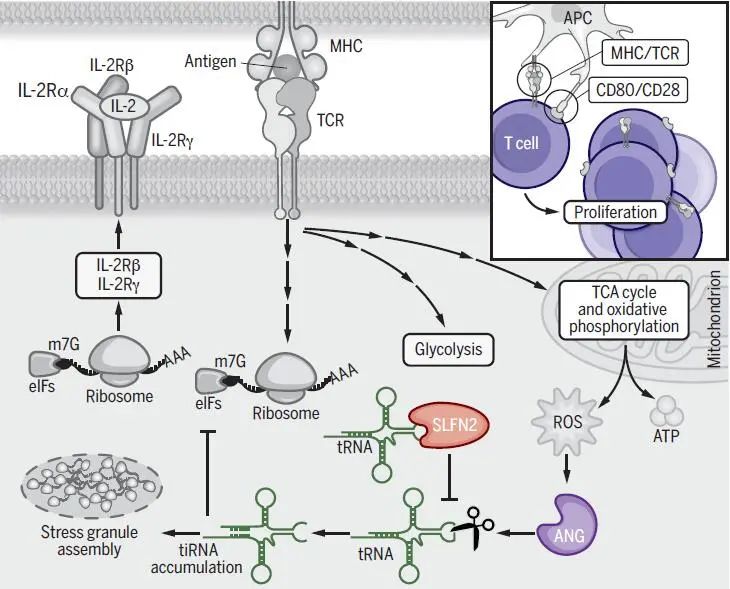
综上所述,本研究揭示了T细胞免疫的一种重要保护机制——SLFN2在免疫激活过程中保护T细胞免受过度应激的损害,从而促进必要的蛋白翻译上调。SLFN2可以结合并保护mRNA翻译过程中的重要分子tRNA,使其免受应激激活的片段化。若SLFN2缺陷,则过度的tRNA片段化会降低整体翻译,特别是降低对T细胞活化重要的关键细胞因子受体蛋白的翻译。由此拓展了tRNA片段化的功能,并阐明了SLFN2在防止片段化以及实现免疫功能方面的作用。
原文链接:
https://doi.org/10.1126/science.aba4220
参考文献
1. C. H. Chang et al., Posttranscriptional control of T cell effector function by aerobic glycolysis. Cell 153, 1239–1251 (2013).
2. S. Ricciardi et al., The Translational Machinery of Human CD4+ T Cells Is Poised for Activation and Controls the Switch from Quiescence to Metabolic Remodeling. Cell Metab. 28, 895–906.e5 (2018).
3. D. G. Franchina, C. Dostert, D. Brenner, Reactive Oxygen Species: Involvement in T Cell Signaling and Metabolism. Trends Immunol. 39, 489–502 (2018).
4. M. Holcik, N. Sonenberg, Translational control in stress and apoptosis. Nat. Rev. Mol. Cell Biol. 6, 318–327 (2005).
5. Z. Su et al., Noncanonical Roles of tRNAs: tRNA Fragments and Beyond. Annu. Rev. Genet. 54, 47 (2020).
6. T. W. Mak et al., Glutathione Primes T Cell Metabolism for Inflammation. Immunity 46, 675–689 (2017).
7. M. Berger et al., An Slfn2 mutation causes lymphoid and myeloid immunodeficiency due to loss of immune cell quiescence. Nat. Immunol. 11, 335 (2010).













